Octubre: Informe de Electroforesis
From 2007.igem.org
SilvanaSaieh (Talk | contribs) |
Alexquintero (Talk | contribs) |
||
| (6 intermediate revisions not shown) | |||
| Line 1: | Line 1: | ||
| - | + | {| | |
| + | | style="background:LightCyan; color:black" | | ||
| - | + | <p style="font-family: Rockwell">Estos son los resultados de corte de las partes. La electroforesis se corrió el 17 de octubre con resultados muy prometedores. </p> | |
| - | + | <p style="font-family: Rockwell"> El 16 de octubre se realizó PCR para amplificar los plásmidos extraídos de nuestras transformaciones. A su vez también se realizaron los cortes con enzimas de restricción XbaI y SpeI para separar nuestras partes de interés de los plasmidos así como también linearizarlos para que queden con extremos cohesivos libres en donde podamos ligar secuencias de nuestro interés. </p> | |
| - | + | <p style="font-family: Rockwell"> A continuación presentaremos la primera electroforesis que se realizó. En esta fotografía se muestran los plásmidos extraídos de las células transformadas químicamente, las partes del BioBrick y las secuencias que vamos a incorporar.</p> | |
| - | |||
| + | <p style="font-family: Rockwell"> Electroforesis 1: Plasmidos extraídos de células transformadas.</p> | ||
| - | + | [[Image:Electro 1.jpg|500px]] | |
| - | 1. | + | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | <p style="font-family: Rockwell"> Carril</p> | |
| + | <p style="font-family: Rockwell">1. Marcador 1Kb</p> | ||
| + | <p style="font-family: Rockwell">2. Parte BioBrick 9O 2135 bp</p> | ||
| + | <p style="font-family: Rockwell">3. Parte BioBrick 2135 bp</p> | ||
| + | <p style="font-family: Rockwell">4. Parte BioBrick 4 P 3078 bp</p> | ||
| + | <p style="font-family: Rockwell">5. Parte BioBrick 4 P 3078 bp</p> | ||
| + | <p style="font-family: Rockwell">6. Parte BioBrick 11 A 2957 bp</p> | ||
| + | <p style="font-family: Rockwell">7. Parte BioBrick 11 A 2957 bp</p> | ||
| + | <p style="font-family: Rockwell">8. Parte BioBrick 13 D 3056 bp</p> | ||
| + | <p style="font-family: Rockwell">9. Parte BioBrick 13 D 3056 bp</p> | ||
| + | <p style="font-family: Rockwell">10. Parte BioBrick 8E </p> | ||
| + | <p style="font-family: Rockwell">11. Parte BioBrick 8E</p> | ||
| + | <p style="font-family: Rockwell">12. Promotor UV 2981bp</p> | ||
| + | <p style="font-family: Rockwell">13. Promotor UV 2981bp</p> | ||
| + | <p style="font-family: Rockwell">14. Exbb 3643bp</p> | ||
| + | <p style="font-family: Rockwell">15. Exbb 3643bp</p> | ||
| + | <p style="font-family: Rockwell">16. Promotor Fe 3951bp</p> | ||
| + | <p style="font-family: Rockwell">17. Promotor Fe 3951bp</p> | ||
| + | <p style="font-family: Rockwell">18. TonB 3641bp</p> | ||
| + | <p style="font-family: Rockwell">19. TonB 3641bp</p> | ||
| - | + | <p style="font-family: Rockwell"> En esta electroforesis encontramos que las transformaciones fueron exitosas por que se puede ver varias bandas con el tamaño esperado de acuerdo a los plasmidos utilizados y además al hacerlas por duplicado se pudo confirmar los resultados. Excepto por las bandas de la parte 9 O y 8 E que no están en donde las esperábamos, todas fueron transformaciones exitosas. Por esta razón se decidió no utilizar las partes antes mencionadas en los siguientes experimentos.</p> | |
| - | + | <p style="font-family: Rockwell"> Posterior a esta prueba se realizaron mas extracciones de estos plasmidos, se corrieron PCR’s de los plasmidos escogidos, y se realizaron los cortes con las enzimas XbaI y SpeI. </p> | |
| - | |||
| - | + | <p style="font-family: Rockwell"> Electroforesis 2: Corte de plasmidos y productos de PCR</p> | |
| - | 2 | + | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| + | [[Image:Electro 2.jpg|500px]] | ||
| - | + | <p style="font-family: Rockwell">Carril</p> | |
| + | <p style="font-family: Rockwell">1. Marcador 1 Kb</p> | ||
| + | <p style="font-family: Rockwell">2. PCR 9 O </p> | ||
| + | <p style="font-family: Rockwell">3. PCR 4 P </p> | ||
| + | <p style="font-family: Rockwell">4. PCR 11 A</p> | ||
| + | <p style="font-family: Rockwell">5. PCR 13 D</p> | ||
| + | <p style="font-family: Rockwell">6. PCR Promotor UV</p> | ||
| + | <p style="font-family: Rockwell">7. PCR Exbb</p> | ||
| + | <p style="font-family: Rockwell">8. PCR Promotor Fe</p> | ||
| + | <p style="font-family: Rockwell">9. PCR TomB </p> | ||
| + | <p style="font-family: Rockwell">10. Espacio</p> | ||
| + | <p style="font-family: Rockwell">11. 4 P con corte por SpeI</p> | ||
| + | <p style="font-family: Rockwell">12. 4 P con corte por XbaI</p> | ||
| + | <p style="font-family: Rockwell">13. 11 A con corte por XbaI</p> | ||
| + | <p style="font-family: Rockwell">14. 11 A con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">15. 11 A con corte por XbaI</p> | ||
| + | <p style="font-family: Rockwell">16. 13 D con corte por XbaI</p> | ||
| + | <p style="font-family: Rockwell">17. 13 D con corte por XbaI y speI</p> | ||
| + | <p style="font-family: Rockwell">18. Promotor UV con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">19. Promotor UV con corte por XbaI</p> | ||
| + | <p style="font-family: Rockwell">20. Promotor UV con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">21. Exbb con corte por Xba y SpeI</p> | ||
| + | <p style="font-family: Rockwell">22. Espacio</p> | ||
| + | <p style="font-family: Rockwell">23. Exbb con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">24. Exbb con corte por XbaI </p> | ||
| + | <p style="font-family: Rockwell">25. Promotor Fe con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">26. Promotor Fe con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">27. Promotor Fe con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">28. Espacio</p> | ||
| + | <p style="font-family: Rockwell">29. Espacio</p> | ||
| + | <p style="font-family: Rockwell">30. TonB con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">31. TonB con corte por XbaI y SpeI</p> | ||
| + | <p style="font-family: Rockwell">32. TonB con corte por XbaI y SpeI</p> | ||
| - | |||
| - | + | <p style="font-family: Rockwell"> Ahora se explicará esta última electroforesis comparándola con la primera desde los últimos carriles; de derecha a izquierda.</p> | |
| - | |||
| - | + | <p style="font-family: Rockwell"> En el carril 30, 31 y 32 están las digestiones del plasmido Psex que contenía la secuencia que codifica para TonB; una de las proteínas que compone el complejo transmembranal para el transporte de moléculas (sideroforos) que captan y hacen mas soluble el hierro para su transporte. El plasmido Psex con la incorporación de esta secuencia tiene un tamaño de 3641 bp y la secuencia sola tiene un tamaño de 843 bp. Como se puede apreciar en la primera fotografía la migración del plasmido completo de forma circular concuerda con el tamaño esperado de 3600 pares de bases. En la fotografía 2 se observa la digestión de este plásmido con dos enzimas de restricción, esto nos produjo 2 bandas de diferente tamaño. La banda que se encuentra mas arriba corresponde al plásmido sin el inserto de interés con un tamaño de 2800 pares de bases y la banda que migro mas, es decir la que se encuentra en la parte baja del gel, corresponde a la secuencia de TonB con extremos cohesivos generados con el corte con XbaI. (Ver los últimos 3 carriles.) Las bandas de interés que contienen la secuencia de TonB fueron cortadas del gel y fueron purificadas utilizando el kit wizar Sv Gel and PCR Clean Up System (Promega R.). Este procedimiento se realizó con todas las secuencias de interés.</p> | |
| - | + | <p style="font-family: Rockwell">Los carriles 27, 26, y 25 tienen el mismo procedimiento, pero esta vez para extraer el promotor de hierro. El plásmido completo tiene un tamaño de 3951 bp y el inserto es de 1153 bp.</p> | |
| - | + | <p style="font-family: Rockwell"> El carril 24 contiene el plásmido Psex con la secuencia que codifica para otra de las proteínas del complejo de transporte de sideroforos llamada Exbb. En este carril se corrió el vector linearizado con un solo corte por XbaI, este procedimiento se realizó para poder utilizar este plasmido como vector de la proteína antes mencionada con el promotor UV una vez se le incorpore, de esta forma se puede tener dos secuencias de interés en un solo plasmido para ser utilizadas en un vector mas grande.</p> | |
| - | + | <p style="font-family: Rockwell">Los carriles 23 y 21 corresponden a este mismo plásmido con un doble corte para extraer la secuencia de Exbb sola, por ende en estos dos carriles se observa una doble banda y en el 24 no. </p> | |
| - | En los carriles | + | <p style="font-family: Rockwell">En los carriles 18, 19 y 20 están los vectores Psex con los promotores UV, en los carriles 18 y 20 se intento realizar un doble corte para extraer el promotor UV solo del plásmido. Lamentable mente la doble banda que se esperaba en estos carriles no apareció y solo se observa una banda. </p> |
| - | En los carriles 5, 6, 7, 8 y 9 se encuentran los productos de PCR amplificados según la convención antes mencionada. | + | <p style="font-family: Rockwell"> Los carriles 17 y 16 contienen las secuencias del BioBrick 13 D (plate 1), esta secuencia es muy importante en nuestro devise por que contiene “senders y receivers”, es decir contiene nuestro componente upstream y downstream. En la electroforesis en el carril 17 se observan dos bandas, la banda que esta mas abajo contiene la parte 13 D aislada, este es un resultado muy importante por que nos va permitir utilizar varias veces esta parte. En el carril 16 se observa este mismo plásmido con un solo corte, linearizado, y listo para adherir las secuencias necesarias. En este carril se puede observar un fenómeno típico en las electroforesis, en donde se observan dos bandas cuando solo debería haber una, esto se presenta por que unos plasmidos se encuentran mas estirados y migran menos por el gel en comparación de los plasmidos linearizados que se encuentran de forma mas compacta.</p> |
| + | |||
| + | <p style="font-family: Rockwell">En el carril 15 se observa la parte del bio brick 11 A (plate 1) linearizada por un corte con enzimas de restricción. En el carril 14 se esperaban 2 bandas para separar la parte 11 A del plasmado que la contiene pero solo una de las enzimas de restricción funciono y en el carril 13 se observa de novo el plasmido linearizado por un solo corte con enzima de restricción. </p> | ||
| + | |||
| + | <p style="font-family: Rockwell">En los carriles 12 y 11 se tiene la parte 4 P linearizada con un solo corte con enzimas de restricción, esta parte es muy importante por que es una de las que maneja el sistema upstream y downstrean y es en donde muy problablemente montemos el devise más completo con todas las partes.</p> | ||
| + | |||
| + | <p style="font-family: Rockwell">En los carriles 5, 6, 7, 8 y 9 se encuentran los productos de PCR amplificados según la convención antes mencionada.</p> | ||
| + | |} | ||
Latest revision as of 21:43, 26 October 2007
|
Estos son los resultados de corte de las partes. La electroforesis se corrió el 17 de octubre con resultados muy prometedores. El 16 de octubre se realizó PCR para amplificar los plásmidos extraídos de nuestras transformaciones. A su vez también se realizaron los cortes con enzimas de restricción XbaI y SpeI para separar nuestras partes de interés de los plasmidos así como también linearizarlos para que queden con extremos cohesivos libres en donde podamos ligar secuencias de nuestro interés. A continuación presentaremos la primera electroforesis que se realizó. En esta fotografía se muestran los plásmidos extraídos de las células transformadas químicamente, las partes del BioBrick y las secuencias que vamos a incorporar.
Electroforesis 1: Plasmidos extraídos de células transformadas. Carril 1. Marcador 1Kb 2. Parte BioBrick 9O 2135 bp 3. Parte BioBrick 2135 bp 4. Parte BioBrick 4 P 3078 bp 5. Parte BioBrick 4 P 3078 bp 6. Parte BioBrick 11 A 2957 bp 7. Parte BioBrick 11 A 2957 bp 8. Parte BioBrick 13 D 3056 bp 9. Parte BioBrick 13 D 3056 bp 10. Parte BioBrick 8E 11. Parte BioBrick 8E 12. Promotor UV 2981bp 13. Promotor UV 2981bp 14. Exbb 3643bp 15. Exbb 3643bp 16. Promotor Fe 3951bp 17. Promotor Fe 3951bp 18. TonB 3641bp 19. TonB 3641bp
En esta electroforesis encontramos que las transformaciones fueron exitosas por que se puede ver varias bandas con el tamaño esperado de acuerdo a los plasmidos utilizados y además al hacerlas por duplicado se pudo confirmar los resultados. Excepto por las bandas de la parte 9 O y 8 E que no están en donde las esperábamos, todas fueron transformaciones exitosas. Por esta razón se decidió no utilizar las partes antes mencionadas en los siguientes experimentos. Posterior a esta prueba se realizaron mas extracciones de estos plasmidos, se corrieron PCR’s de los plasmidos escogidos, y se realizaron los cortes con las enzimas XbaI y SpeI.
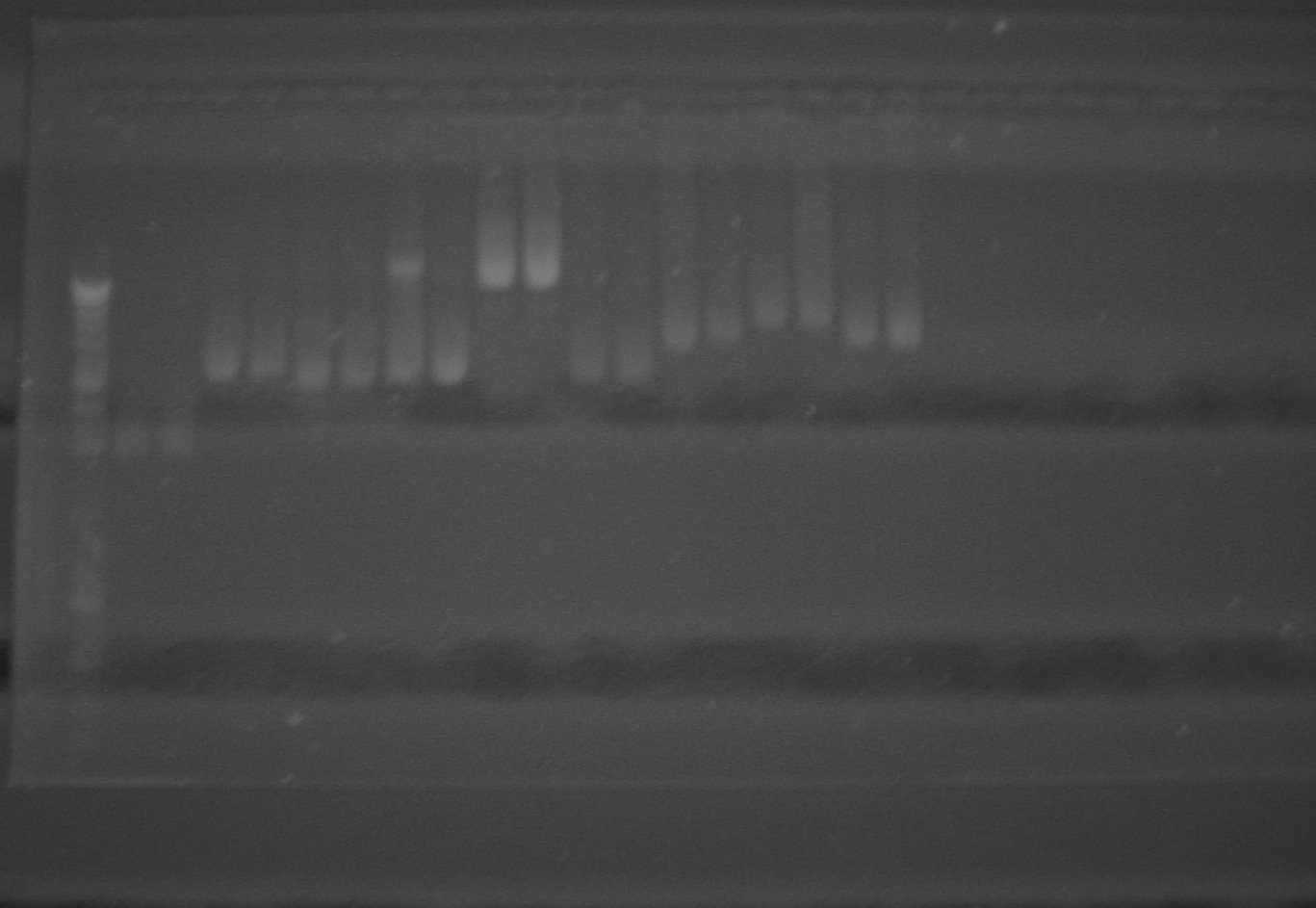
Electroforesis 2: Corte de plasmidos y productos de PCR Carril 1. Marcador 1 Kb 2. PCR 9 O 3. PCR 4 P 4. PCR 11 A 5. PCR 13 D 6. PCR Promotor UV 7. PCR Exbb 8. PCR Promotor Fe 9. PCR TomB 10. Espacio 11. 4 P con corte por SpeI 12. 4 P con corte por XbaI 13. 11 A con corte por XbaI 14. 11 A con corte por XbaI y SpeI 15. 11 A con corte por XbaI 16. 13 D con corte por XbaI 17. 13 D con corte por XbaI y speI 18. Promotor UV con corte por XbaI y SpeI 19. Promotor UV con corte por XbaI 20. Promotor UV con corte por XbaI y SpeI 21. Exbb con corte por Xba y SpeI 22. Espacio 23. Exbb con corte por XbaI y SpeI 24. Exbb con corte por XbaI 25. Promotor Fe con corte por XbaI y SpeI 26. Promotor Fe con corte por XbaI y SpeI 27. Promotor Fe con corte por XbaI y SpeI 28. Espacio 29. Espacio 30. TonB con corte por XbaI y SpeI 31. TonB con corte por XbaI y SpeI 32. TonB con corte por XbaI y SpeI
Ahora se explicará esta última electroforesis comparándola con la primera desde los últimos carriles; de derecha a izquierda.
En el carril 30, 31 y 32 están las digestiones del plasmido Psex que contenía la secuencia que codifica para TonB; una de las proteínas que compone el complejo transmembranal para el transporte de moléculas (sideroforos) que captan y hacen mas soluble el hierro para su transporte. El plasmido Psex con la incorporación de esta secuencia tiene un tamaño de 3641 bp y la secuencia sola tiene un tamaño de 843 bp. Como se puede apreciar en la primera fotografía la migración del plasmido completo de forma circular concuerda con el tamaño esperado de 3600 pares de bases. En la fotografía 2 se observa la digestión de este plásmido con dos enzimas de restricción, esto nos produjo 2 bandas de diferente tamaño. La banda que se encuentra mas arriba corresponde al plásmido sin el inserto de interés con un tamaño de 2800 pares de bases y la banda que migro mas, es decir la que se encuentra en la parte baja del gel, corresponde a la secuencia de TonB con extremos cohesivos generados con el corte con XbaI. (Ver los últimos 3 carriles.) Las bandas de interés que contienen la secuencia de TonB fueron cortadas del gel y fueron purificadas utilizando el kit wizar Sv Gel and PCR Clean Up System (Promega R.). Este procedimiento se realizó con todas las secuencias de interés. Los carriles 27, 26, y 25 tienen el mismo procedimiento, pero esta vez para extraer el promotor de hierro. El plásmido completo tiene un tamaño de 3951 bp y el inserto es de 1153 bp. El carril 24 contiene el plásmido Psex con la secuencia que codifica para otra de las proteínas del complejo de transporte de sideroforos llamada Exbb. En este carril se corrió el vector linearizado con un solo corte por XbaI, este procedimiento se realizó para poder utilizar este plasmido como vector de la proteína antes mencionada con el promotor UV una vez se le incorpore, de esta forma se puede tener dos secuencias de interés en un solo plasmido para ser utilizadas en un vector mas grande. Los carriles 23 y 21 corresponden a este mismo plásmido con un doble corte para extraer la secuencia de Exbb sola, por ende en estos dos carriles se observa una doble banda y en el 24 no. En los carriles 18, 19 y 20 están los vectores Psex con los promotores UV, en los carriles 18 y 20 se intento realizar un doble corte para extraer el promotor UV solo del plásmido. Lamentable mente la doble banda que se esperaba en estos carriles no apareció y solo se observa una banda. Los carriles 17 y 16 contienen las secuencias del BioBrick 13 D (plate 1), esta secuencia es muy importante en nuestro devise por que contiene “senders y receivers”, es decir contiene nuestro componente upstream y downstream. En la electroforesis en el carril 17 se observan dos bandas, la banda que esta mas abajo contiene la parte 13 D aislada, este es un resultado muy importante por que nos va permitir utilizar varias veces esta parte. En el carril 16 se observa este mismo plásmido con un solo corte, linearizado, y listo para adherir las secuencias necesarias. En este carril se puede observar un fenómeno típico en las electroforesis, en donde se observan dos bandas cuando solo debería haber una, esto se presenta por que unos plasmidos se encuentran mas estirados y migran menos por el gel en comparación de los plasmidos linearizados que se encuentran de forma mas compacta. En el carril 15 se observa la parte del bio brick 11 A (plate 1) linearizada por un corte con enzimas de restricción. En el carril 14 se esperaban 2 bandas para separar la parte 11 A del plasmado que la contiene pero solo una de las enzimas de restricción funciono y en el carril 13 se observa de novo el plasmido linearizado por un solo corte con enzima de restricción. En los carriles 12 y 11 se tiene la parte 4 P linearizada con un solo corte con enzimas de restricción, esta parte es muy importante por que es una de las que maneja el sistema upstream y downstrean y es en donde muy problablemente montemos el devise más completo con todas las partes. En los carriles 5, 6, 7, 8 y 9 se encuentran los productos de PCR amplificados según la convención antes mencionada. |