Chiba/Making Marimo
From 2007.igem.org
|
Introduction | Project Design ( 1.Affinity Tag | 2.Communication Module | 3.Size Control ) | Making Marimos | Our Goal |
Making Marimos
Parts Construction
Because we found that FliC code includes restriction enzyme(EcoRI,SpeI,PstI) which is used in Biobrick, we divided into plasmid of FliC and one of signal, and aimed the double transformation.
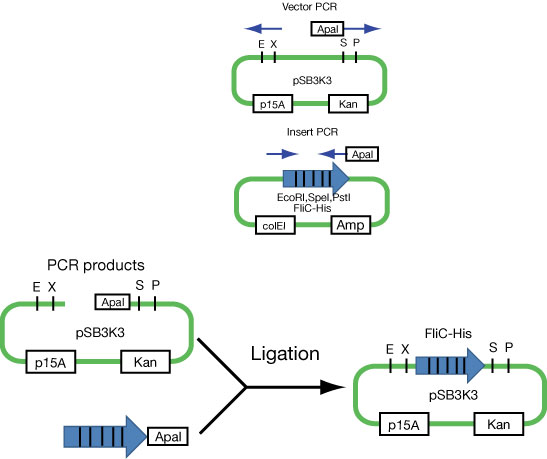
FliC-His generator
Experiment
- We regulate His-tagged FliC by lux promoter. Namely, if LuxR is expressed, bacteria can express FliC by Quorum Seinsing.
- Because the gene circuit of Quorum Sensing is on vector of colEI, we can use FliC and Quorum Sensing by using vector of p15A and do double transformation.
Results
Failed to ligate FliC-His generator and p15A origin vector.
- 混乱しています。ごめん。確認なんですが、FliC-His generatorをp15Aにのせるというのは、Biobrickにするためでないでしょうか。。僕の勘違いかな?。。そもそもQuorum sensing のベクターと、FliC-Hisチェックしてビーズ吸着させたときのベクターとを、ダブルトランスフォーメーションできないんだっけ?byとよたろ
FliC-his biobrick
Experiment
- ここの文章の意味が伝わりにくいです。細かい話になりすぎるのであれば、この箇所はカットしてもいいと思います。byとよたろ
- Change puc19 vector into biobrick's vector.
(puc19 vectorの乗っているのでbiobrickのベクターに乗せる。)
- Broken restriction sites of enzyme(EcoRI,SpeI,PstI).
(制限酵素サイト(EcoRI,SpeI,PstI)をつぶす。)
- Can't insert vector directly,because FliC-His contains EcoRI,SpeI,PstI.
- Insert blunt end on one side and ApaI on the other side.
- Similarly do PCR and ligation in the vector side.
(FliC His-TagにはEcoRI,SpeI,PstIが含まれているために、そのままではvectorに入れられない。
- 片側をblunt end もう一方をApaIの制限酵素サイトをつけ、PCRする。
- vector側も同様にPCRしLigationさせる。)
Results
Not yet (as of 10/26/2007). Cloning is still underway (ligation failed) -->