Chiba/Engeneering Flagella
From 2007.igem.org
|
Introduction | Project Design | Engeneering Flagella | Quorum Sensing | Our Goal || Team Members | メンバ連絡簿 |
Our Aim
大腸菌同士を吸着させるため,我々は(細胞の外側に突出しているもののうち)鞭毛に着目した. (図:イメージ)
About flagella
大腸菌は5~10?本/細胞(<chemotaxisの本で要確認)の鞭毛を持つ.鞭毛を回転/逆回転させることにより環境の良い場所へとtaxisする.鞭毛は長さ約10~15μm,半径約23nmの空孔のチューブ状である.(図:菌全体)
鞭毛のフィラメント部はFliCという蛋白質が規則正しく配列した多量体である.(図:鞭毛アップ)
FliCはD0,D1,D2,D3ドメインを持つ.(種類によってはD1,D2,D3の3つのドメインを持つ)D1とD2はformation of the functional flagellar formation(ffff)の為に必要であるが,D3ドメインは必要でなく可変である(図:蛋白質構造&鞭毛断面図)
(Ref)
"Variable" FliC D3 domain
可変なD3ドメインに他の<__aaまでの>アミノ酸を挿入しても鞭毛が合成される[2]. 詳細も書く.
References
- Kuwajima, G. et al.: Nature Biotechnology, 6, 1080-1083 (1988).
- Tanskanen, J. et. al.: Appl. and Env. Microbiol., 4152-4156 (2000)
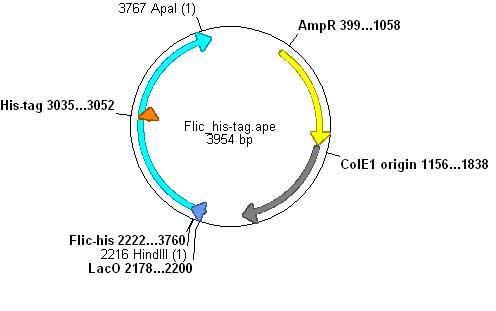
Parts Assembly
FliC-hisの作成
- FliC遺伝子のD3領域に、Histidineループをコードする遺伝子を挿入し、ヒスチジンタグとして発現させる。
→Linker Ligation
- 完成プラスミド
- Phenotypeをチェック→SDS-PAGE,Western-Blotting
- ヒスチジンタグがFliC遺伝子の外側に発現していることを確認する。
→Beads adsorption
FliC-His generator
- His-tagを入れたFliCをpLuxの下に置き、LuxRが発現されている条件のもとならば、Quorum SensingでFliCを発現させることができるようにする。
- Quorum Sensingのための遺伝子回路がcolEI oriのvectorに乗っているために、p15Aのベクターを使いdouble transformation することでQuorum Sensingと合わせることができるようになる。
- pLuxをもつベクター側とFliCをPCRを使って、Ligationさせることで作る。
FliC-his biobrick
必要なこと
- puc19 vectorの乗っているのでbiobrickのベクターに乗せる。
- 制限酵素サイト(EcoRI,SpeI,PstI)をつぶす。
- FliC His-TagにはEcoRI,SpeI,PstIが含まれているために、そのままではvectorに入れられない。
#片側をblunt end もう一方をApaIの制限酵素サイトをつけ、PCRする。 #vector側も同様にPCRしLigationさせる。
Experiments
Display Check: Beads Adsorption
Purpose
FliC-hisが発現され,鞭毛を形成してるか("鞭毛にFliC-hisがディスプレイされてるか"?)を確認する.
Method
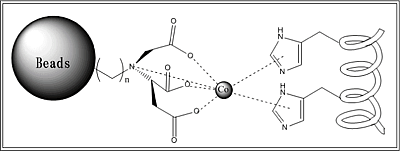
ビーズ吸着の説明. ヒスチジンはCo(またはNi)と錯体結合?をする.表面に金属イオン(本実験ではCo2+およびNi2+)を配置したビーズを使用して,FliC-hisがディスプレイされた大腸菌とそうでないものを調べた.
ビーズには4つのカルボキシル基のついた炭素鎖がついていて、二価の金属イオンの6つの配位部位のうち、4つと配位結合している。さらに残りの二つの配位部位に、Histidineのイミダゾール基が配位する。このため、Histidine Tagが鞭毛にDisplayされている大腸菌と、ビーズ溶液を懸濁させれば、鞭毛上のHistidineと金属イオンとを媒体として、鞭毛がBeadsに吸着する。この懸濁溶液にMagnetを近づけることにより、BeadsはMagnetに引き寄せられ、Beadsを含まない溶液を上澄みとして分離できる。さらにこのBeadsにImidazoleを含むバッファーを加えれば、このImidazoleがHistidineのImidazole基と競合し、金属イオンにHistidineよりも強い力で配位するため、鞭毛がBeadsからはずれる。ここで再びMagnetを近づければ、大腸菌のついていないBeadsと、大腸菌がいる上澄み溶液とに分離される。この上澄み溶液をプレートにinculateし、コロニーをチェックする。コロニーが形成されれば、鞭毛にHistidine TagがDisplayされているということがわかる。
(<不十分&不正確です.直してください)
Samples
- GI826 < 欠損は?
- pUC19-FliC-His
- plasmidなし
- GI826 <同上
- pUC19-FliC-his
- plasmidなし
Procedure
- pUC19-FliC-His,をKeio⊿FliC株にトランスフォーメーション。培養液をビーズと懸濁させ、大腸菌をBeadsに吸着する。
吸着した大腸菌をbufferで溶出し、inculateする。(Negative Control 1:Noplasmid,Negative Control 2:Co2+あるいはNi2+の有り・無し) →吸着していなかった
- pUC19-FliC-His,をKeio⊿FliC⊿MotB株にトランスフォーメーション。培養液をビーズと懸濁させ、大腸菌をBeadsに吸着する。
吸着した大腸菌をbufferで溶出し、inculateする。(Negative Control 1:Noplasmid,Negative Control 2:Co2+あるいはNi2+の有り・無し) →吸着していた。
Results
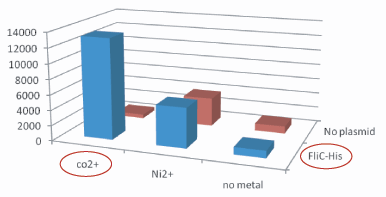
Plasmidあり、かつCo2+つきビーズ、のコロニー数は、その他のものよりはるかに多い。30倍以上。 Histidine Tagの存在によって大腸菌がビーズに吸着吸着していることがわかる。